
第85期
出刊日:2019-01-15
返回上一層中、晚期肝癌新戰場新療法輩出 點燃病人希望
肝癌若能愈早發現,愈有機會進行手術切除或電燒這種根除性治療,然而若發現時已經是中、晚期,過去多半僅能採取栓塞或標靶藥物。唯近年不僅標靶藥物陸續有新藥問世,還多了免疫療法這個選項,醫界也朝使用兩種免疫藥物或標靶加免疫的「組合療法」進行研究,抗癌武器愈來愈多,中晚期肝癌病人愈來愈有希望。
諮詢/陳健弘(臺大醫院雲林分院內科部主任、臺大醫學院內科副教授)
撰稿/張雅雯
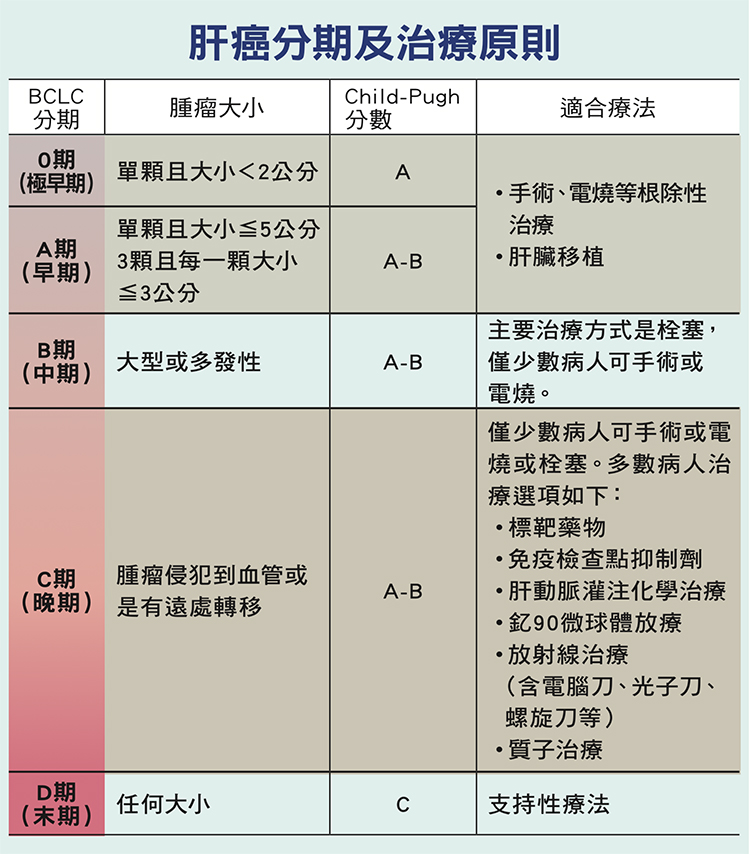
癌症的分期會影響治療策略,肝癌也不例外。肝癌有數種分期方式,目前最常使用的是美國肝病醫學會也採用的BCLC(Barcelona Clinic Liver Cancer)分期系統,將肝癌分為0、A、B、C、D等5期。
不過,分期僅是原則,臨床上對於肝癌的治療,不會完全依照分期來考量,醫師會依據病人本身的狀況,包括有無肝硬化、肝功能的情形,以及腫瘤大小與位置適不適合手術切除,選擇最合宜的治療策略。
肝功能好壞 影響治療選擇
愈早期發現肝癌、愈有機會手術切除或電燒處理,這兩種都稱為根除性治療,適用對象主要以BCLC的第0期及A期病人為主。若病人肝功能良好,且腫瘤數量僅單顆、直徑不超過5公分,或是3顆以內、最大直徑不超過3公分,治療策略優先考慮手術切除;若是多發性肝癌,需視病人狀況個別判定是否適合手術切除。
評估肝功能主要看的是Child-Pugh分數,Child A病人肝功能良好,因此治療選擇最多,存活率也最好;Child B表示有中度肝硬化,治療選項開始受限;Child C代表已經嚴重肝硬化,肝功能太差可能導致無法做治療,這時多半只能給予症狀緩解的支持性療法。
早期肝癌:可採手術或電燒根除性治療
若可以手術或電燒,如何選擇?整體而言,手術的復發率較電燒為低,因為能避免留下殘餘腫瘤細胞,但兩者存活率卻差不多,因為腫瘤復發後,還是可以接受後續的治療。
不過,手術或電燒有時並非單選題,可以互相配合使用,比如病人有一大一小兩顆腫瘤,位於肝臟不同的區位,可以手術切除大顆腫瘤、電燒治療小顆腫瘤,以減少肝臟切除過大範圍而損及肝臟機能,因此治療方式並非二擇一不可,視病人的狀況而定。
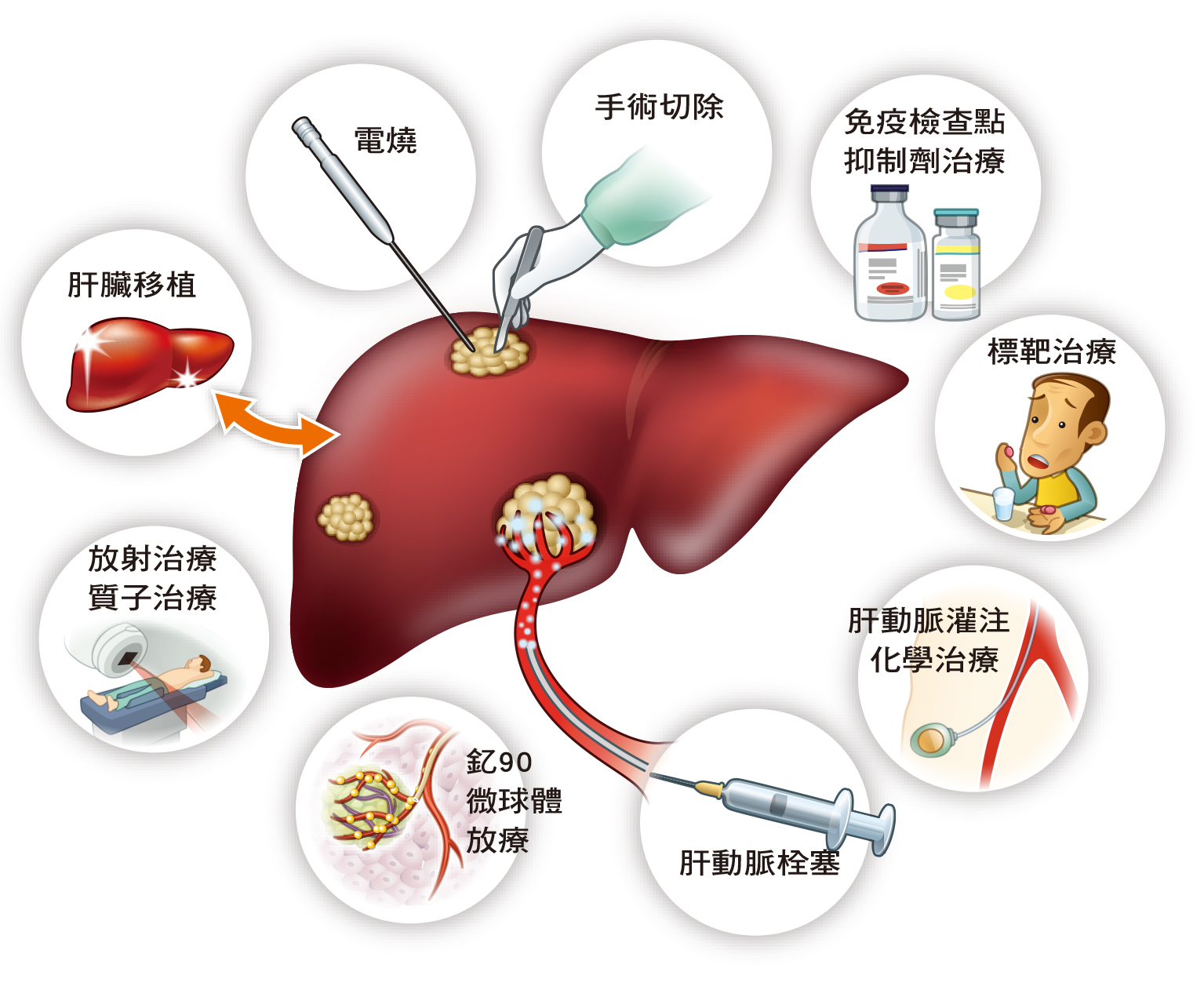
俗稱電燒的「無線射頻燒灼術」(Radiofrequency Ablation,RFA),是肝癌局部燒灼(Ablation)的方式之一,用於早期肝癌腫瘤的清除率達95%以上,除了傳統以單一根針燒灼,處理較大腫瘤時還可以多針同時處理,擴大燒灼的範圍。
現在還有一種「次世代微創微波肝腫瘤滅除術」,其實這並非新的發明,微波原本就是肝癌局部消融的一種方式,1、20年前就有這項技術,只是第一代的微波儀器效果不好,因此後來被電燒取代。現行的微波儀器是改良後再推出,因此號稱「次世代」,機器是新的、但技術其實是舊的,適用的範圍理論上也跟電燒差不多,是以早期肝癌為主,唯健保尚未給付。
肝臟移植也是選項之一。肝癌病人要移植,前提是肝癌未侵犯血管也未發生遠端轉移,目前台灣普遍採用加州大學舊金山分校標準:單顆肝癌不超過6.5公分、多顆肝癌不超過3顆、且肝癌直徑總和不超出8公分。符合上述條件者,移植效果也最好。
中晚期肝癌:主戰場在栓塞與藥物
然而若病人肝癌屬於BCLC的B或C期,也就是中、晚期的肝癌病人,能夠手術切除或電燒的機會不多,整體來說,到C期只有一小部分病人可以手術切除,必須由醫師判斷什麼樣的病人才適合。
至於電燒在中、晚期肝癌能發揮的機會更少,大概僅少部分的B期病人可以做,因為治療範圍沒那麼大。雖然臨床上曾有電燒處理單一顆7公分腫瘤的經驗,但並非每個中期肝癌病人都適合;對於晚期肝癌病人來說,由於腫瘤已經入侵血管或遠處轉移,基本上完全不適合電燒。
因此,不同於早期肝癌病人以根除性治療為主,肝癌中、晚期病人的治療原則雖然仍是「能開刀則開刀」,但必須另闢戰場。目前實證有療效但非根除性治療的選項,中期主戰場在栓塞、晚期主戰場在標靶藥物及免疫藥物;以BCLC分期來說,B期的第一線治療選擇就是做栓塞、C期的第一線治療就是標靶治療,免疫療法則放在第二線。
栓塞阻斷肝動脈營養補給 殺死腫瘤
肝動脈栓塞(Transarterial Chemoembolization, TACE)目前仍是肝癌病人無法接受手術或電燒時的治療首選。肝癌的營養來源主要來自肝動脈,栓塞是把導管伸入肝動脈,把水溶性化療藥物與油性物質(Lipiodol)混合,注射到供應肝癌的肝動脈分支內,然後再打入栓塞凝膠粒子(Gelfoam)予以阻塞,達到切斷腫瘤的糧食供應、讓腫瘤缺少血液供應及化學治療的雙重作用而死亡;至於正常的肝臟,因為還有門靜脈可供應血流,比較不會受到影響。
不適合手術及電燒的病人,若病人肝功能不會太差,且本身沒有肝門靜脈阻塞或逆流問題,優先選擇做肝動脈栓塞,即使接受栓塞的腫瘤再度復發、或是從肝臟其他地方長出腫瘤,只要評估沒有絕對不能做的禁忌症,仍可做栓塞治療,沒有次數的上限。
另一選擇:肝動脈灌注化療
如果肝癌病人合併肝門靜脈主幹阻塞,就不適合做肝動脈栓塞,否則肝臟的兩條主要供血路徑都堵住,會嚴重影響肝臟功能,這樣的病人通常優先考慮標靶藥物治療。如果標靶治療有不可承受的副作用,或是效果不如預期,也可以採用肝動脈灌注化學治療,因為灌注化療不會把肝動脈塞住,且不同於一般化療從中央靜脈給藥,肝動脈灌注化療是直接針對供應肝腫瘤營養的肝動脈給予藥物,直接作用在肝臟,但必須預先把通往鄰近胃腸道的血管堵住,避免引起全身性的副作用。
肝癌若已轉移 多採標靶藥物
還有一類肝癌病人的腫瘤已經侵犯到肝門靜脈,這時容易透過門靜脈跑到肝臟其他地方,也就是肝內轉移,肝腫瘤數量往往從一顆變成多顆,這類病人屬於肝癌晚期,目前標準療法就是使用口服標靶藥物,但臨床上病人對於標靶藥物的腫瘤反應率僅約5~10%。
肝動脈栓塞加放射線治療 療效試驗中
為了替中晚期病人爭取更多生機,醫界開始試驗採用栓塞加上放射線治療,原理就是以栓塞處理肝臟內的肝腫瘤,另以放射線治療來處理肝門靜脈內的腫瘤,理論上可達到相輔相成的效果,但須待更多臨床試驗證實後,才能確定是否成為一種治療選項。
同樣是以栓塞的原理來治療肝癌,近年還發展出釔90微球體放療。歐洲腫瘤內科學會(ESMO)建議,栓塞治療失敗或效果不佳者,可考慮做釔90。這是利用導管將含有放射性物質(釔90)的微球體送入肝腫瘤處,宛如埋入一顆地雷,在體內引爆、殺死癌細胞,臨床上認為適用對象會比傳統栓塞更廣一點,腫瘤只要沒侵犯到門靜脈主幹,即使侵犯到分支門靜脈也有不錯的治療效果,但自費價格不斐。
放射線治療居輔助角色
當上述治療都沒辦法做,或不適合做,可以考慮做放射線治療。放射線治療有許多不同的名稱,如電腦刀、光子刀、螺旋刀等,其實原理都是利用放射線去照射腫瘤,讓腫瘤細胞壞死,只是這些「刀」,標榜立體定位、多角度把能量聚焦在腫瘤,可減少對正常組織的傷害。
儘管如此,放射線仍會傷及正常組織,而同樣屬於放射線的質子治療沒有這個問題。質子射線到達要治療的腫瘤深度時,就會停在那裡釋放出大量能量,這個能量高峰稱為布拉格峰(Bragg peak),腫瘤後方的正常組織幾乎不會接受到任何能量,因此可以用很高的放射線劑量治療腫瘤。
但質子治療目前需自費,費用依照療程次數多寡從30萬到70萬不等。考量自費昂貴,通常建議不適合手術、電燒,或栓塞效果也不佳者,再考慮質子治療。
晚期肝癌:首選標靶藥,其次免疫療法
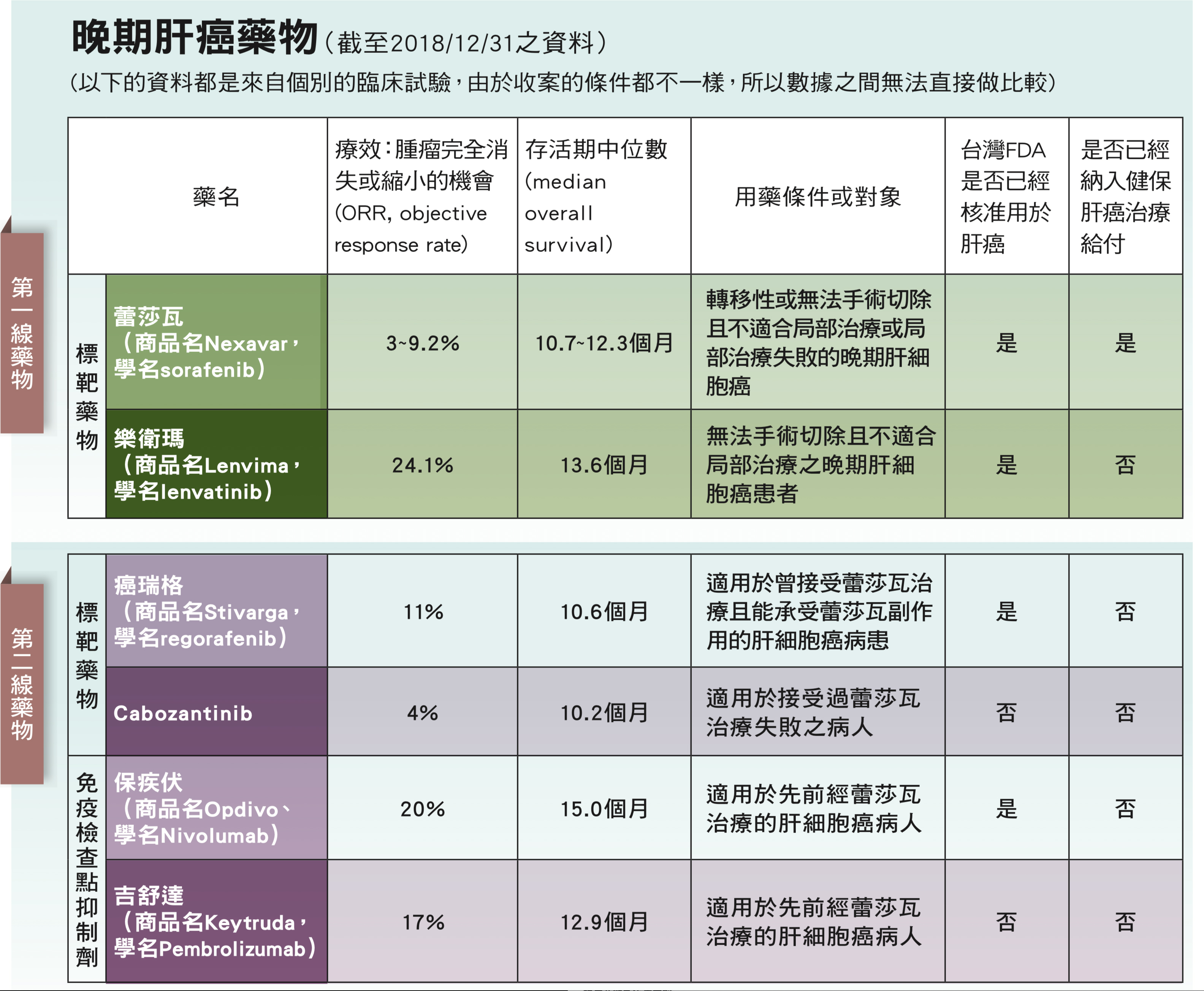
對於晚期肝癌病人來說,治療首選是標靶藥物,不過肝癌的標靶藥物進展不如其他癌症迅速。以第一個肝癌標靶藥蕾莎瓦(學名Sorafenib)來說,2007年11月美國食物藥品管理局(FDA)核准用來治療肝癌,台灣則是2012年8月核准用於肝癌,此後直到2017年,才有第二個標靶藥癌瑞格(學名Regorafenib)被核准用於肝癌。
蕾莎瓦對肝癌的治療效果很有限,腫瘤縮小的比率僅2~3%,但對於晚期肝癌病人來說已經是一大突破。至於新推出的癌瑞格,腫瘤縮小的比率則約10%,它是蕾莎瓦的衍生物,但能辨識比蕾莎瓦更廣泛的標的分子,因而所導致的副作用也更強烈,因此病人必須能忍受蕾莎瓦的副作用,才能使用癌瑞格,台灣目前規定第一線先用蕾莎瓦,治療無效才使用第二線的癌瑞格。
2018年8月美國FDA又核准樂衛瑪(學名Lenvatinib)可用於已經轉移或無法切除的肝細胞癌病人之一線用藥。Lenvatinib組的平均癌症無進展生存期(progression-free survival,PFS)為7.3個月,顯著高於sorafenib組的3.6個月。台灣FDA也已核准用於無法手術切除且不適合局部治療之晚期肝細胞癌患者。
肝癌標靶藥物未來可望有更多選項,另一個藥物是已經使用在腎細胞癌、甲狀腺癌的標靶藥物Cabozantinib,在晚期肝癌的第二線治療臨床試驗中看到療效,臨床試驗結果也已發表在2018年的新英格蘭雜誌(N Engl J Med 2018;379:54-63)。總共有707個蕾莎瓦治療失敗的肝癌病人接受Cabozantinib臨床試驗,被分配到服用Cabozantinib的病人,中位數存活期是10.2個月,被分配到服用安慰劑的病人,中位數存活期是8.0個月。服用Cabozantinib的病人的存活月數統計上顯著優於服用安慰劑的病人。
免疫檢查點抑制劑治療肝癌陸續核准上市
晚期肝癌藥物的另一項重大突破,就是免疫療法的運用。免疫療法是近年來癌症治療的新希望,涵蓋許多不同的方式,其中一種稱為免疫檢查點抑制劑(immune checkpoint inhibitor)。
PD-1免疫抑制劑保疾伏(學名Nivolumab)是最早獲准用於肝癌的免疫檢查點抑制劑,根據該藥用於肝癌的第二期全球臨床試驗結果,約20%的病人腫瘤縮小,2017年9月下旬獲得美國FDA核准為肝癌的第二線用藥,台灣也在2018年9月核准用於肝癌,衛福部許可證之適應症為:「適用於先前經sorafenib治療的肝細胞癌(HCC)病人」。
另一個PD-1免疫檢查點抑制劑吉舒達(商品名Keytruda,學名Pembrolizumab),同樣針對蕾莎瓦治療失敗的病人進行臨床試驗,其結果已經公佈。共有104名肝癌病人接受治療, Child-Pugh分級為A或B,病人每3週接受Keytruda 200mg,直至出現不可接受的毒性或確診的疾病進展。腫瘤完全消失或縮小的機會(objective response rate;ORR)為17%,其中完全緩解率為1%,部分緩解率為16%,中位數存活期為12.9個月。2018年11月9日已獲得美國FDA核准為晚期肝癌的第二線用藥。台灣尚未核准用於肝癌。
令人矚目的還有,併用免疫藥物PD-L1抑制劑atezolizumab(商品名為Tecentriq,癌自癒)及標靶藥物bevacizumab(商品名Avastin,癌思停)治療晚期肝癌病人的臨床試驗正在進行中。免疫檢查點抑制劑與蕾莎瓦的比較,也尚待研究結果發表。
組合療法將是未來趨勢
免疫療法雖然讓晚期肝癌治療增加新的可能性,要注意的是,這些臨床試驗,收案時均排除兩類對象:已經有自體免疫疾病正在接受相關治療,或是接受過器官移植的病人。前者是自體免疫系統已經過度活化、後者則長期吃抗排斥藥,考量使用免疫療法的風險太高,且完全沒有相關的安全性與療效資料可參考,因此有這兩類問題的肝癌病患,不建議使用免疫療法。
總之,目前晚期肝癌的治療原則是先用標靶藥物,治療失敗再用免疫療法。但醫界正朝以下幾個方向研究,包括免疫療法嘗試挑戰運用於第一線治療,另外也嘗試「組合療法」,也就是同時運用兩種免疫療法、或是標靶藥物加上免疫療法等,這將是未來晚期肝癌治療的趨勢。
一般認為,組合療法的效果應該會更好,但副作用勢必也會跟著增加,其風險效益仍有待更多臨床試驗結果出爐後,才能論斷。
請別錯過本期其他精彩內容…
- 總編輯的話:新年展新局 消滅肝病再升級
- 胰臟癌 早期難發現6成患者診斷已是第4期
- 「武功高強」惜難敵肝癌武俠小說大師金庸病逝
- 質子治療殺肝癌 2年存活率約7成
- 健保給付全口服新藥不設限根除C肝可望提早達標
- 同時有B肝和C肝,如何治療較好?
- B肝病毒量爆表,應該趕快用藥嗎?
- 性傳染病比你想得還要多!肝炎與愛滋有共病風險
- B肝根治有望嗎?藥物積極研發中
- 肝癌,開刀?不開刀?
- 胃有點破皮,是怎麼了?
- 胃悶痛、消化不良…當心萎縮性胃炎!
- 罹患大腸直腸癌,一定要做人工肛門嗎?
- 肝爹信箱 有問必答
- 跑出健康 公益愛延續!
- 肝臟健康「照」得住!新北市勞工首次大規模「腹部超音波肝癌大篩檢」
- 2019年「救救肝苦人」再升級
- 【請問好心肝】腸胃科5問邱世賢醫師 專業解答
- 【請問好心肝】 身心科4問胡海國教授 專業解答
- 【請問好心肝】 胸腔科7問李麗娜教授 專業解答
- 【請問好心肝】 內分泌暨新陳代謝科5問黃天祥教授 專業解答
- 【請問好心肝】 泌尿科4問周淇業醫師 專業解答
- 【好心肝故事】 先生肝炎驟逝 捐款支持擴建郭玲慧:好心肝,好用心
- 【好心肝故事】 健檢才知眼中風藍秋桂:好心肝助我重見色彩