
第101期
出刊日:2023-01-11
返回上一層晚期肝癌又有新組合療法 單一標靶藥仍有角色
對於無法接受手術或電燒等根除性治療以及經動脈栓塞治療的晚期肝癌病人,標靶加免疫療法的組合目前是首選,近來又有新的雙免疫療法問世,組合療法看似已是趨勢。不過,醫師也觀察到,在部分臨床試驗中單獨使用標靶藥的療效也不差,用藥仍應考量病情、經濟等條件,做出最適當的選擇。
諮詢╱許駿(臺大醫院癌醫中心分院腫瘤內科部及教學研究部主任、臺大醫學院腫瘤醫學研究所特聘教授)、楊宏志(臺大醫院內科部主治醫師、臺大醫學院微生物學科教授)
撰稿╱黃靜宜
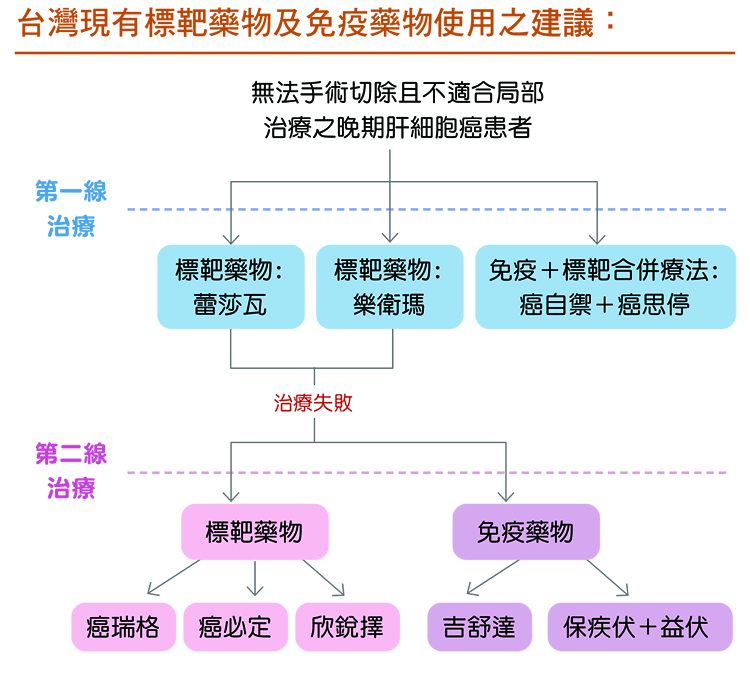
【註:蕾莎瓦(商品名Nexavar,學名Sorafenib)、樂衛瑪(商品名Lenvima,學名Lenvatinib)、癌瑞格(商品名Stivarga,學名Regorafenib)、癌必定(商品名Cabometyx,學名Cabozantinib)、欣銳擇(商品名Cyramza,學名Ramucirumab)、吉舒達(商品名Keytruda,學名Pembrolizumab)、保疾伏(商品名Opdivo,學名Nivolumab)、益伏(商品名Yervoy,學名Ipilimumab)】
晚期肝癌第一線藥物可分為單用標靶藥物及免疫加標靶兩大類。標靶藥物包括蕾莎瓦、樂衛瑪;免疫加標靶即癌自癒(Tecentriq,學名Atezolizumab)與癌思停(Avastin ,學名Bevacizumab)併用,俗稱為A+B或Double A。此合併療法的臨床試驗顯示,治療反應率(Objective response rate,簡稱ORR,也就是腫瘤會縮小的比率)約30%;腫瘤穩定維持不惡化的平均時間約7個月,存活中位數(Overall survival,簡稱OS)則為19.2個月。
癌思停是抗血管新生藥物,癌自癒是抗PD-L1免疫檢查點抑制劑,醫界推測癌思停不完全只有抗血管新生,可能也有免疫促進的效果。
至於晚期肝癌第二線療法,則有標靶藥物和免疫療法等多種。
美國核准新的雙免疫療法
美國食品藥物管理局(FDA)於2022年10月通過一個新的雙免疫療法組合(Durvalumab+Tremelimumab),可作為無法切除之肝細胞癌患者的第一線治療。其中Durvalumab(商品名:Imfinzi 抑癌寧)是抗PDL1的免疫檢查點抑制劑,Tremelimumab是抗 CTLA4免疫檢查點抑制劑(國內尚未上市)。在一項名為Himalaya study的臨床試驗中,在存活中位數(OS)方面,雙免疫為 16.4 個月,蕾莎瓦組13.8 個月,具有統計學意義和臨床意義的改善。
Durvalumab+Tremelimumab這組治療的反應率(ORR)為20.1%,明顯優於蕾莎瓦組(5.1%)。
此一臨床試驗共收案782人,分為3組,一組注射這兩種藥物(雙免疫),一組每4周注射一次Durvalumab(單免疫),最後一組每天口服兩次蕾莎瓦(標靶),試驗目標是雙免疫要比標靶好,單免疫不比標靶差。試驗結果顯示有達到目標。至於雙免疫有沒有比單免疫好?在這個試驗中並未探究。
副作用方面,最常見(>20%)的不良反應是皮疹、腹瀉、疲勞、搔癢、肌肉骨骼疼痛和腹痛。
截至2022年底國內尚未通過此一組合療法用於晚期肝癌。

樂衛瑪加吉舒達的組合 臨床試驗未成功
雖然組合療法漸成晚期肝癌治療趨勢,但有另一項名為 LEAP-002的臨床試驗,比較樂衛瑪及樂衛瑪加上抗PD1免疫檢查點抑制劑吉舒達(Keytruda,學名Pembrolizumab)這兩組的效果。因樂衛瑪有健保給付,原本醫界期待若證實此組合療效優於單獨使用標靶藥物,病人只要自付另一個免疫療法藥物,經濟負擔可以少一些,不料2022年8月試驗結果揭曉,組合療法並未優於單用樂衛瑪,臨床試驗未能成功,讓醫界頗感意外。
根據該臨床試驗結果,樂衛瑪加吉舒達的腫瘤縮小機率(ORR)26.1%,單用樂衛瑪則是17.5%,沒有達到統計學上的意義。但樂衛瑪在這個臨床試驗的中位存活數(OS)接近19個月,樂衛瑪加吉舒達為21.2個月,相差不遠,引起注意;因為當初樂衛瑪上市前的臨床試驗設計與這次幾乎一樣,存活時間是12個月,等於經過這幾年,樂衛瑪的療效一舉延長了7個月。
這也許可以用階段效果(period effect)來解釋。這是一個統計學名詞,隨著時間過去,當診斷技術提升或醫療型態改變,病人可能在疾病的更早階段,身體狀況更好的時候就開始治療,治療效果就可能因此進步。
韓國有一篇實際使用經驗的研究,有兩群病人,一群用A+B,一群用樂衛瑪,結論是療效差不多。但這篇是回溯性研究,證據力不及雙盲隨機試驗,所以是不是真的一樣,仍不敢斷言。
【圖說:晚期肝癌藥物的選擇多,但用藥複雜度也增加。】
臨床試驗無法解答所有疑問 該用哪種藥物陷入「選擇困難」比起只有蕾莎瓦單一標靶藥物的時代,現在晚期肝癌藥物愈來愈多,還分成第一線與第二線,進步之大不可同日而語。不過即使是效果較好的標靶加免疫,腫瘤可以明顯縮小的機會也是3成左右;加上肝癌免疫療法尚無健保給付,十分昂貴,該選哪種藥?不僅病人陷入「選擇困難」,醫師在建議如何用藥時,面對每個病人的條件不同,也常面臨兩難。
再者,臨床試驗的結果與真實世界的使用經驗不一定全然相符,臨床試驗成功的一定比失敗的好嗎?免疫組合療法是否就優於單一免疫或標靶藥物?藥廠主導的臨床試驗結束後,某些科學上的疑點無法透過進一步分析或更長期追蹤得到答案。因此,也不是絕對有效或沒效這樣的二分法;這些情況都增添了選擇用藥的複雜度與困難度。
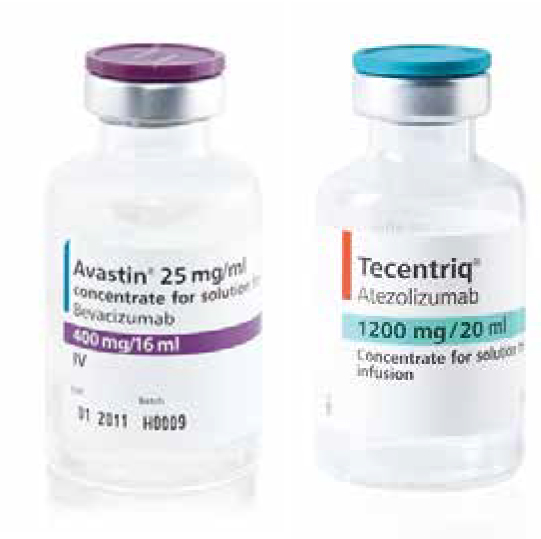
【圖說:癌自禦+癌思停是晚期肝癌第一線療法】
優先使用哪種藥?各有考量因素
原則上,若優先考量肝癌根除率、反應率,會建議病人先選A+B。這個選項的最大問題是費用,因為如果病人屬於有效的那3成,建議治療至腫瘤惡化為止,所以總治療時間可能會很長,一個月藥費在十幾、二十幾萬之間,病人要考量是否能負擔。
優先使用哪種藥?各有考量因素
原則上,若優先考量肝癌根除率、反應率,會建議病人先選A+B。這個選項的最大問題是費用,因為如果病人屬於有效的那3成,建議治療至腫瘤惡化為止,所以總治療時間可能會很長,一個月藥費在十幾、二十幾萬之間,病人要考量是否能負擔。
不過免疫療法提供比較高的完全反應率,也就是大概有5%的人腫瘤完全消失,是最吸引人的地方。
單用免疫療法也有15∼20%的腫瘤反應率,若病人受不了標靶藥物的副作用,單用免疫療法也是一個選項。
免疫療法是否有效,多久可見真章?統計顯示,40%的病人使用免疫療法兩個月內就可以觀察到效果,60%要超過兩個月。以3週一個療程來看,就是至少要做完第3個療程,才能知道有沒有效。
若經濟不足以支應免疫療法,則可先使用標靶藥物蕾莎瓦、樂衛瑪。要注意的是,若使用樂衛瑪失敗,要接續第二線藥物的話,目前健保沒有給付;使用蕾莎瓦失敗,健保有給付第二線藥物。
此外,病人的肝功能也要考量,所有的標靶藥物只建議使用於肝功能為Child-Pugh A的病人;Child-Pugh B以上的用藥則應依照專家建議決定是否使用免疫療法,但肝功能愈差,治療效果會打折,所以還是要早點治療。有些病人治療到後面,肝功能也不太好,所以能用的藥物也不多。
前導性治療縮小腫瘤 再開刀或電燒
除了不斷有新的藥物組合問世,晚期肝癌治療還有另一趨勢是,藉由前導性治療縮小腫瘤,再安排栓塞、電燒或開刀等接續治療。例如透過免疫或標靶加免疫療法,把腫瘤縮小後,外科醫師若評估可以開得乾淨,那就可以開刀。這也是一位日本近畿大學醫學院附屬醫院Masatoshi Kudo(工藤正俊)教授提倡的概念。
這雖然是一個重要的發展方向,不過,臨床上,接受A+B治療後腫瘤可以縮小的病人只有3成,要縮小到可以開刀的程度,又更少。
此外,有時病人腫瘤縮小後,也會猶豫要不要再去開刀,怕開刀反而又引起其他的問題,但繼續打免疫療法下去,經濟也是一大負擔。一般來說,這些問題都要在治療前事先跟病人溝通,病人願意接受,才開始治療。畢竟到目前為止,免疫加標靶治療有效者,還沒有明確的停藥時間,大多仍需繼續用藥。整體來說,晚期肝癌藥物雖較十年前大有進步,但還是有很多不完美之處,尚待後續研究努力。
請別錯過本期其他精彩內容…
- 探索脂肪肝的致病因子 未病先防!
- 知名音樂人罹肝癌 兒子捐肝救不回 積極追蹤、治療 走出「肝病三部曲」陰影
- 資深演員肝硬化入院 肝硬化併發症多 需積極控制
- 逆轉脂肪肝, 腸道菌可能是解方?!
- 控制體重的秘密在腸道?! 從減重手術如何改變腸道菌叢談起
- 方式多、療效日益顯著 免開刀消融肝腫瘤!
- 多針雙電極電燒也可燒中大型腫瘤 一次多根針包夾圍攻!
- 機器手臂 大範圍切肝也辦得到 讓更多病人免於開腹大刀
- 親人需要肝移植, 捐肝如何評估?
- 肝膽腸胃科的長新冠
- 【愛肝新樂園】根除肝癌,也要「動態清零」?
- 手指易僵硬冰冷, 也跟C肝有關?!
- 上腹痛厲害,真的是胃在痛嗎? 也可能是膽出問題!
- 腸躁症, 低腹敏飲食 可改善?
- 肝爹信箱 有問必答
- 凝聚愛心,邁向無肝病的國度 肝基會榮獲第六屆 「堉璘台灣奉獻獎」
- 保平安、保健康! 台北指南宮免費抽血及癌篩 近千人響應
- 大腸癌分期4問 謝銘鈞教授專業解答
- 兒童身高5問 劉士嶢醫師專業解答
- 大腸鏡前清腸5問 柯智傑醫師專業解答
- 腸胃鏡麻醉5問 陳建榮醫師專業解答
- 影像檢查放射3問 鄧宇娟醫師專業解答
- 范振坤先生抗癌10年 愛子捐肝,重獲好「新」肝
- 好心肝門診中心擴建,11樓門診服務正式啟動 亟需您的愛心「掛名」襄助