
第102期
出刊日:2023-04-07
返回上一層肝臟成為「治病重鎮」 把核酸藥物送進肝臟,可根治肝外疾病!
隨著基因與疾病之間的關聯性越來越清楚,帶動相關藥物的研發;特別是以肝臟相關蛋白質為標的開發的核酸藥物,因為可以從根本解決疾病的發生,可能改變未來的治療模式,也是目前全球製藥業發展重點。
諮詢╱陳培哲(中央研究院院士、臺大醫學院臨床醫學研究所教授)
撰稿╱黃筱珮、黃靜宜
撰稿╱黃筱珮、黃靜宜
2022年底,美國食品藥物管理局(FDA)批准澳洲藥廠CSL Behring治療血友病的新藥Hemgenix上市,這款新藥採注射的方式,將能夠產生正常凝血因子的基因運送到肝臟,從根本治療血友病,扭轉了病人需終身輸血的命運。這款新藥定價350萬美元(約新台幣1億元),成為目前世上最昂貴的藥物。
Hemgenix此藥不僅因定價昂貴掀起話題,更重要的是,它是一款以肝臟凝血因子相關蛋白質為標的而開發出的核酸藥物。核酸是由許多核苷酸聚合而成的生物大分子化合物,為生命的最基本物質之一,可分為去氧核糖核酸(DNA)和核糖核酸(RNA)。類似這種針對肝臟某些重要的RNA或DNA開發藥物,來治療肝外疾病的方式,顛覆大多數既有藥物的治療模式,非常受到矚目。
肝臟是製造蛋白質最大基地
缺乏特定蛋白質引發多種疾病
能夠形成這樣的治療途徑,主要因為肝臟是「人體超級化工廠」,是身體製造蛋白質最主要的基地,肝臟製造出的蛋白質會參與身體許多器官的運作,例如腎臟、心臟、免疫系統、代謝功能⋯等,與血液凝固有關係的重要蛋白質「凝血因子」絕大多數也是由肝臟製造。
當肝臟製造某些蛋白質的功能異常,例如太多或太少,都可能引發各種疾病。因此,若能透過調控肝臟所製造的蛋白質的對應基因(包括RNA或DNA),使肝臟製作出的蛋白質數量或功能正常,就可以治療相對應的肝外疾病。
核酸藥物的問世,讓這個想法得以成真。所謂的核酸藥物,包括小片段核苷酸序列,所謂的核酸藥物,包括小片段核苷酸序列,包含:mRNA (messenger RNA)、siRNA(small interfering RNA)、miRNA(microRNA)及DNA,科學家透過病毒載體或可傳輸核酸的脂質奈米粒子(LNP)技術,讓核酸藥物可以到達肝臟,並進入肝細胞內進行基因調控,改變特定蛋白質的生成;而且藥效可以穩定維持,且不會引起嚴重的免疫反應,達到治療目的。比起透過病毒載體,以LNP運送核酸藥物或修飾核酸更可減少身體出現免疫反應,是目前主流的方式。
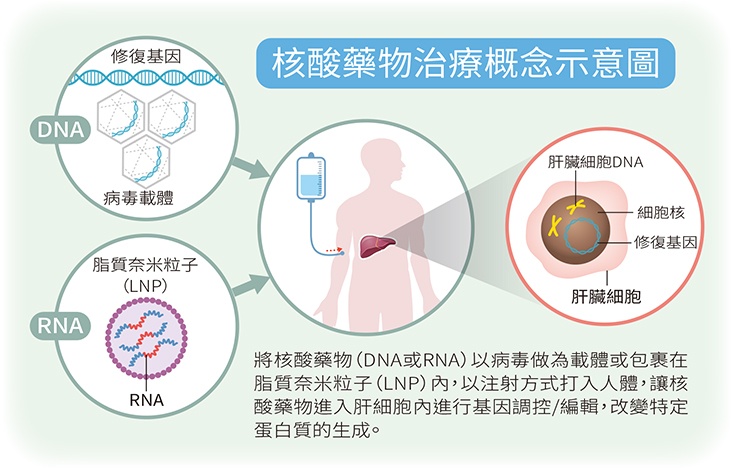
將製造凝血因子之正常基因送至肝臟
根本治療血友病
目前已問世的核酸藥物,最具代表性的就是治療血友病的藥。
血友病是一種先天遺傳性疾病,是因為肝臟製造凝血因子的基因功能缺損所致。缺乏第八凝血因子為A型血友病,缺乏第九凝血因子為B型血友病,病人不只血液不易凝固、易出血,且會導致關節受損。
目前治療血友病是採用定期注射凝血因子方式,以維持患者體內凝血因子的濃度;而最新研發的核酸藥物,可將製造凝血因子的正常基因(DNA)以病毒載體送至肝臟,讓病人肝臟可自行合成正常的凝血因子,達到根本治療的效果。
Hemgenix上市後的定價,主要是根據血友病人若長期輸血,廿年下來累積的藥物費用大約就是一億元左右;而核酸藥物能夠提供一次性根本治療,使凝血因子產出的功能趨於正常,相當於這個高昂代價。
核酸藥物
可治療「豬木」生前罹患的疾病
還有一些疾病則是因為肝臟製造過多蛋白質沉積在體內各處所造成,「轉甲狀腺素蛋白類澱粉沉積心肌病變」(簡稱AATR)就是其中一例。AATR是一種體染色體顯性遺傳疾病,主因是「轉甲狀腺素蛋白」(transthyretin, TTR)基因突變造成的。正常情況下,TTR會摺疊成一個四聚體,但當肝臟所製造的TTR單體數量太多或異常時,就會經由血液循環全身而逐漸積聚在身體眾多組織器官,成為有害的類澱粉蛋白,例如積聚在心臟、周邊神經系統等,導致病人心臟衰竭或神經病變,最終失能或死亡。
根據統計,心臟衰竭的患者之中,有5∼10%是因為AATR引起,2022年病逝的日本摔角明星豬木,生前也飽受AATR所苦。過去醫藥界對於AATR一直沒有很好的治療方式,所幸美國FDA在2018年核准核酸藥物patisiran,可用於成人因AATR導致的遺傳性澱粉樣多發性神經病變,為此病治療帶來新希望。
Patisiran是一種微小核酸藥物(siRNA),原理是把調控「轉甲狀腺素蛋白」訊息的RNA經過適當修飾,並包裹在脂質奈米顆粒之中,以注射方式打入人體後,可降解掉(即減少)異常生成TTR的RNA,如此就能減少致病蛋白質合成,達到治療目的。但此法是針對RNA,致病的DNA還在,仍會持續製造出致病的RNA,所以每隔一段時間就要再注射一次藥物。
結合基因編輯技術 可改變致病的DNA
為此,藥廠持續研發從DNA解決的辦法。2022年在《新英格蘭醫學期刊》(The New England Journal of Medicine , NEJM)發表一篇研究,以基因編輯(CRISPR/Cas9)方式,把RNA放在脂質奈米顆粒裡,並且在顆粒外加上載脂蛋白E(ApoE);因為肝細胞表面有ApoE受體,以注射方式將此藥打入人體後,就能與肝細胞表面的ApoE受體結合,進入肝細胞。RNA進入肝細胞內,就能產生基因編輯的功能,把致病的DNA透過基因編輯改正。該藥物的臨床試驗顯示,注射一次就可以減少7成以上的異常蛋白質合成,剩下2、3成幾乎不會致病,等於是有根治效果。
AATR這個例子,說明了以肝臟為標的,用siRNA藥物可以把致病蛋白質的RNA減少,達到治療效果;但光是處理RNA還不能根治疾病,如果結合基因編輯技術,連同致病的DNA也改正,讓DNA做不出致病的RNA及蛋白質,就可以根本性的解決疾病。
頑固型高血脂症 核酸藥物帶來新契機
AATR是心臟和神經方面的疾病,卻可以透過肝臟來治療,這是一個全新的方向。AATR和血友病都還是比較少見的疾病,事實上,核酸藥物也可以運用在比較常見的疾病,例如高血脂症。
高血脂症是膽固醇或三酸甘油酯數值超出標準,特別是俗稱「壞膽固醇」的低密度脂蛋白膽固醇(LDL-C)數值過高。高血脂症與肝臟有相當密切的關係,肝細胞表面有LDL-C的受體LDLR,能有效捕捉血液中的LDL-C進入到肝臟內,血液中的LDL-C就會降低,但是有些人的LDL-C受體特別少,原因竟是肝臟製造的另一種蛋白質PCSK9會把LDL-C的受體分解掉,因此無法把血液中的LDL-C帶進肝臟,血脂就會居高不下。有些高血脂症患者服用史塔汀類(Statin)的降血脂藥物也不見效,原因就出在這裡。
科學家想到,如果利用siRNA技術讓此類患者的PCSK9減少,肝臟表面的LDL-C受體就會增加,就能解決此一問題。
美國FDA於2021年底核准首款降低膽固醇的小核酸藥物Leqvio,能夠有效抑制PCSK9合成;PCSK9減少,LDL-C的受體就會相對穩定,LDL-C的代謝就能趨於正常。研究發現,這類核酸藥物每半年注射一次,患者的膽固醇就會降低50%,對於家族性高血脂症以及動脈硬化心血管疾病患者而言是一大福音。
三高疾病之中的高血壓、糖尿病,以及盛行率逐年增加的阿茲海默症、腎臟發炎等疾病,相關核酸藥物的開發亦如火如荼進行,只要能找到肝臟所製造的蛋白質與該種疾病的關聯性,就有機會治療過去束手無策或難解的疾病。
雖然目前核酸藥物定價普遍高昂,尚無法普及,未來若技術更成熟或藥廠專利期過後,就有機會降價,讓更多人受惠。
肝功能不好無法使用核酸藥物
上述的例子說明了,因為肝臟製造的蛋白質與許多疾病可能有關係,所以以肝臟為「基地」開發核酸藥物,可以治療許多疾病,目前看來療效也令人滿意,安全性也高。而且肝臟是核酸藥物最容易進入的器官,因為肝細胞表面有許多受體,可和藥物結合,其他器官如肺臟、心臟都不容易將藥物送進去。
正因肝臟扮演重要的角色,肝臟功能不好的患者目前無法使用核酸藥物;肝臟本身的疾病,例如B肝、肝硬化、肝癌等,目前也無法受惠於核酸藥物,有賴後續研究突破。
透過基因編輯
嘗試找出根治B肝療法
不過,醫藥界也致力於研究基因編輯的方式,期待有一天能找到安全有效的方式,能夠透過編輯DNA,一勞永逸根除疾病。
例如慢性B型肝炎,目前有口服抗病毒藥物,絕大多數病人在規律服藥下,都可以達到在血液中檢測不到病毒的結果。即便如此,肝臟內仍會躲藏著具有複製能力的B肝病毒共價閉合環狀DNA(cccDNA),一旦停藥後,高達9成機率病毒會再開始旺盛複製,因此B肝無法根治,多半得長期用藥。未來,若能運用CRISPR/Cas9基因編輯技術,直接校正cccDNA,可能是治癒B肝的契機。
不過相較於RNA核酸藥物的安全性,基因編輯的一大隱憂是所謂的「脫靶效應」(off-target effects),也就是未照原訂計畫去編輯目標基因的DNA,反而改變身體中其它不該改變的基因段,造成人體不可逆的傷害,因此有賴更多研究與實驗,才能運用於臨床。
請別錯過本期其他精彩內容…
- 總編輯的話|謹慎用藥,不傷肝
- 3大學會共識: 糖尿病患應積極篩檢C肝並治療 降低併發症風險
- 歌王歌后聲帶灼傷 竟是「胃食道逆流」所致
- 藥物性肝損傷易輕忽 吃補、吃藥 當心傷肝!
- 大腸息肉切除「 冷」、「熱」有別! 研究證實冷切可減少出血率
- 我得肝癌的機率有多高? 風險預測模型可找出高風險族群
- 看「胃相」掌握胃癌風險 人工智慧判讀快又準
- 殺菌防胃癌 不影響腸道菌平衡 第二線救援四合一療法效果好
- 愛肝新樂園|有膽結石,留著當舍利子?
- 好不容易換肝卻失敗,怎麼會這樣?
- 從NAFLD 到MAFLD 脂肪肝病更名, 凸顯與代謝異常息息相關!
- 易與急性腸胃炎混淆 發炎性腸道疾病發生率上升 掌握正確診斷及治療關鍵
- 胰臟開刀, 需要選達文西機械手臂嗎?
- 肝爹信箱 有問必答
- 今年超了沒?全民腹超總動員 前進阿里山部落 發現8 位疑似肝腎腫瘤
- 憂鬱症5問 胡海國教授專業解答
- 小兒包皮過長5問 賴鴻緒教授專業解答
- 貧血3問 田蕙芬教授專業解答
- 女性更年期5問 華筱玲醫師 專業解答
- B肝病毒量7問 洪俊銘醫師 專業解答
- 好心肝故事|臺大沈冬教授的健檢體悟 想完成天命,得維持健康!
- 好心肝門診中心擴建,11 樓門診服務正式啟動 亟需您的愛心「掛名」襄助 歡迎各界愛心人士或企業認捐 用愛守護國人健康