
第107期
出刊日:2024-07-12
返回上一層【晚期肝癌新進展】 第一線治療新增雙免疫藥物 新穎免疫治療模式的曙光
免疫療法已成為抗癌利器,晚期肝癌的第一線治療有新的免疫藥物組合入列;除了近幾年廣泛使用的免疫檢查點抑制劑(immune checkpoint inhibitors)外,其他免疫治療方式(例如癌症疫苗、細胞治療)在固態腫瘤(包括肝細胞癌)的初步臨床試驗結果也顯示有機會奏效!
諮詢╱許駿(臺大醫學院腫瘤醫學研究所特聘教授、臺大醫院癌醫中心分院教學研究部主任)
撰稿/李宜芸、黃靜宜
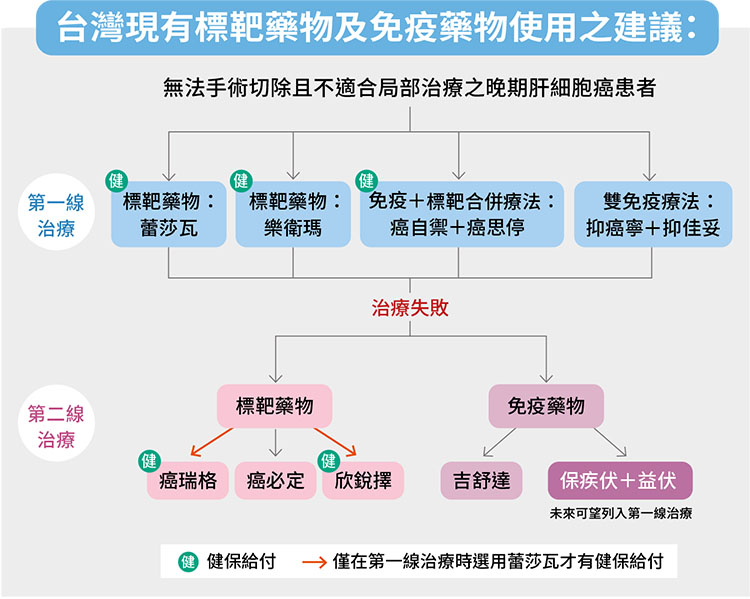
近幾年晚期肝癌的藥物選擇愈來愈多,目前有健保給付的第一線用藥包括標靶藥物蕾莎瓦(sorafenib)、樂衛瑪(lenvatinib),以及免疫加標靶藥物組合「癌自癒(atezolizumab)+癌思停(bevacizumab)」,也就是俗稱的A+B或者double A,此一藥物組合已於2023年8月有條件納入健保給付。
若第一線藥物無效,第二線療法有癌瑞格(regorafenib)、癌必定(cabozantinib)、欣銳擇(ramucirumab)等標靶藥物可以選擇;免疫療法則有吉舒達(pembrolizumab)或雙免疫藥物組合「保疾伏(nivolumab)+益伏(ipilimumab)」。若考慮健保給付,目前只有第一線選擇蕾莎瓦卻失敗的病人,才有機會使用健保給付之癌瑞格與欣銳擇。
第一線治療新增雙免疫藥物
值得注意的是,晚期肝癌的第一線治療有新進展,新增一款雙免疫療法組合:抑癌寧(durvalumab)+ 抑佳妥(tremelimumab)。此一組合早在2022年即通過美國食品藥物管理局(FDA)核准,其中抑癌寧是抗PD-L1的免疫檢查點抑制劑,幾年前已在台上市,而抑佳妥則是抗CTLA-4之免疫檢查點抑制劑,遲至今(2024)年在國內上市,療程只需打一針,但費用十分高昂,且因劑量較高,也要小心副作用。
從一項名為Himalaya的臨床試驗研究可知,使用「抑癌寧+抑佳妥」組合的病人,存活中位數(OS)是16.4個月,與使用蕾莎瓦組的病人存活中位數13.8個月相比,具臨床意義上的改善。此外,此組合的治療反應率(ORR)為20.1%,也明顯優於蕾莎瓦組的5.1%。因此,目前「抑癌寧+抑佳妥」的雙免疫療法已被列入國際肝細胞癌臨床診療指引,可作為晚期肝癌的第一線藥物選項。
此一組合目前健保並未給付,癌友若想用藥需考量病情、副作用及經濟狀況,且未必所有醫院都有進藥。
「保疾伏+益伏」
亦可望列入第一線治療
此外,2024年5月舉行的美國臨床腫瘤學會(American Society of Clinical Oncology, ASCO)中,一項研究發表引起矚目,為雙免疫療法組合「保疾伏+益伏」與第一線標靶藥(在這個試驗中有約85%對照組受試者使用樂衛瑪,15%使用蕾莎瓦)的比較,臨床試驗進行多年追蹤後,今年發表完整的存活分析結果。
研究顯示,在臨床試驗的前期,雙免疫療法組與標靶藥物組的療效並未看到太大的差別,大約一年半後,兩組病人的存活曲線才逐漸拉開。在24個月時,使用「保疾伏+益伏」雙免疫藥物組合的病人存活率達49%,使用蕾莎瓦或樂衛瑪則是39%;在36個月時,使用「保疾伏+益伏」的病人存活率為38%、使用蕾莎瓦或樂衛瑪的存活率為24%。整體存活時間中位數(overall survival)的比較,「保疾伏+益伏」組為23.7個月、蕾莎瓦或樂衛瑪組為20.6個月,達到統計學上顯著的差異。
而在治療反應率(objective response rate,腫瘤縮小的機率)上,「保疾伏+益伏」為36%、蕾莎瓦或樂衛瑪則為13%。腫瘤縮小維持的時間,「保疾伏+益伏」為30個月,蕾莎瓦或樂衛瑪為12.9個月。也就是說,使用「保疾伏+益伏」的優勢是,腫瘤縮小的機會變大,而且如果縮小的話,可以維持較久的時間。
不過此一研究中,標靶藥物樂衛瑪的表現也值得關注,研究顯示,標靶藥物組的病人平均存活時間也接近2年,打破過去所有肝癌標靶治療臨床試驗的紀錄。過去樂衛瑪與蕾莎瓦比較或蕾莎瓦與A+B此一組合比較時,標靶藥物組病人平均存活期大約只有13個月。對照組的存活時間成績不斷進步,是過去分析晚期肝細胞癌臨床試驗成績時經常被提出討論的議題。可能原因包括各種支持性治療的進步,有更多替代療法可供選擇,以及病患可能在更早期、腫瘤負擔(tumor burden)較低、身體狀況較好時即加入試驗等。
雙免疫療法
需注意免疫相關副作用的監控
在療效之外,雙免疫療法的副作用也需注意。「保疾伏+益伏」臨床試驗顯示,不管是雙免疫治療組或者是標靶藥物組,兩組的副作用程度均被歸類在grade3/4,也就是出現較嚴重、需要住院或者接受醫療照顧的副作用機率數據相似,分別是41%與42%;不過臨床實務上,免疫療法與標靶藥物的副作用不同,醫療照顧的方式與強度也不一樣。
尤其,「保疾伏+益伏」雙免疫治療組值得關注的副作用為肝臟發炎,有19%的病人出現肝臟發炎,其中大多數為grade3/4並需要使用高劑量的類固醇治療,這是使用蕾莎瓦或樂衛瑪不至於發生的情況,應為免疫療法引起。一旦發生,需要謹慎處理。
而與近期列入晚期肝癌第一線的雙免疫治療「抑癌寧+抑佳妥」相同,目前「保疾伏+益伏」的藥物組合也未有健保給付,因此決定是否用藥前也需考量經濟狀況,與醫師討論最適合的治療策略。
整體而言,目前晚期肝癌第一線治療的選項,從過去只有單一標靶藥物蕾莎瓦或樂衛瑪,短短幾年內進展快速,增加了免疫加標靶或者雙免疫的治療選項,對病人最顯而易見的好處就是對抗病魔的武器增加了。以目前臨床觀察,多數癌友第一線會選擇健保給付的「癌自癒+癌思停」組合,若使用此一組合無效接續使用其他第二線藥物,目前皆須自費,因此,不管是第一線或者第二線的藥物都可以嘗試,只是療效如何缺乏大規模臨床試驗的數據,但幾年後可能陸續會有不同醫院的個別用藥經驗以「真實世界資料」(real world data) 形式發表,可供參考。
其他免疫治療用於實體腫瘤已見到曙光
除了免疫檢查點抑制劑外,近年有多種新穎免疫治療在不同實體腫瘤(solid tumors)的早期臨床試驗顯示可能的治療潛力。首先是癌症疫苗 (cancer vaccine)的發展:由於次世代基因定序的大幅進步,研究者可以針對個別癌症病患的癌細胞進行定序,找出具有特異性的癌症抗原(neoantigen),再以此neoantigen製成「個人化」(personalized) 疫苗,強化病患的抗癌免疫反應,併用anti-PD1免疫檢查點抑制劑有機會進一步提高療效。此一作法已經在黑色素細胞癌、胰臟癌等的早期臨床試驗顯示初步療效。
今年美國Johns Hopkins大學醫院率領的研究團隊在接受過標靶藥物治療的晚期肝細胞癌病患嘗試此一治療模式,36位受試者中有11位腫瘤得到完全或部分緩解(Yarchoan M等,Nature Medicine 2024)。幾家發展新冠肺炎疫苗成功的藥廠(BioNT、Moderna)目前也積極投入開發個人化癌症疫苗。國內針對肝細胞癌病患目前尚無個人化癌症疫苗的臨床試驗。
CAR-T治療肝癌也展露頭角
其次是經基因改造的細胞治療(chimeric antigen receptor T cells, CAR-T)在實體腫瘤的治療運用。CAR-T全名為「嵌合抗原受體T細胞療法」,做法是抽取病人的T細胞做原料,在專門的實驗室進行基因改造,時間約需2~3周。改造後的T細胞可辨識帶有特定標靶的癌細胞進而精準擊殺,且輸入病人體內後會持續大量複製,猶如一支強大的軍隊不斷對付癌細胞。目前針對化療效果不佳的血液腫瘤病患,CAR-T已經是重要的救援治療之一。近年最新的臨床試驗更將CAR-T運用於各種實體腫瘤,甚至結合其他免疫療法以產生更好的效果。
今年ASCO年會上,中國浙江大學醫學院發表了以CAR-T治療肝癌的第一期臨床試驗。該研究以肝細胞癌表面的一個特異性高的分子glypican-3作為標的設計CAR-T。在23位可評估療效的受試者中,有超過一半受試者腫瘤有不同程度縮小,且因為CAR-T造成的免疫相關副作用相對輕微(Zhang Q等,ASCO2024, abstract #4018)。儘管仍有許多技術的細節待澄清,長期的療效與安全性待追蹤,但此研究結果顯示CAR-T用於肝癌或其他固體腫瘤治療是值得發展且可行的領域。目前臺大醫院癌醫中心分院即將與美國生技公司合作,在台灣展開肝細胞癌CAR-T臨床試驗計畫。
不過CAR-T治療也有風險,病人在接受CAR-T治療前,需接受淋巴清除性化療,此階段白血球趨近於零,免疫力十分低下,要嚴格注意感染問題。製作CAR-T需將病人的T細胞送往國外進行基因改造,約需等待一個月,若病人病況嚴重,也要考量是否能等待。過去血液腫瘤病患接受CAR-T治療的長期追蹤結果顯示,少數(目前資料應小於1%)病患後續產生T細胞白血病,可能與基因改造的CAR-T細胞有關。此外,CAR-T治療所費不貲,在未來的臨床應用將是另一門檻。
無論如何,晚期肝癌的治療武器愈來愈多元,選項越來越多,而最新的生力軍CAR-T也展露頭角,可望為晚期肝癌病人帶來更多希望。
請別錯過本期其他精彩內容…
- 總編輯的話|感動的30年
- 國人以愛心寫就 「消滅肝病」動人篇章
- 偏鄉離島宮廟監獄…哪裡需要哪裡去 肝病防治列車 篩檢不中斷
- 一呼百應 社會愛心力量的凝聚
- 從堅強病友到熱心義工 肝苦人最懂肝苦人
- 肝病治療多元進步:絕境逢生的故事
- 消滅肝病最後一哩路與未來展望
- 財團法人肝病防治學術基金會 大事紀
- 超音波導引下, 浮生近半世紀感言
- 【2023年國人死因公布】慢性肝病及肝硬化第12名 排名連兩年下降 顯示防治奏效
- B型肝炎診療 台灣與國際現況剖析
- 降血脂藥statins 可以減少慢性肝病的進展風險?
- 愛肝新樂園|你要「美鈔」還是要「腹超」?
- 腹痛、嘔吐, 是腸子打結、阻塞了?
- 肝爹信箱 有問必答
- 肝基會攜手新北市衛生局 「超了沒」前進新北汐止區
- 肝基會攜手新竹縣衛生局 新竹縣C肝微根除 「共下」來愛肝
- 攜手7-ELEVEN 2024年「今年超了沒」 公益募款活動開跑!
- 拔毛癖5問 張俊祥醫師專業解答
- 睡眠呼吸障礙5問 李佩玲醫師專業解答
- 注意力不足過動症 ADHD 6問 郭雅君醫師專業解答
- 兒童腸胃疾病6問 蘇韋如醫師專業解答
- 虹彩炎及葡萄膜炎5問 林昌平醫師專業解答
- 好心肝門診中心擴建診間服務 5 樓門診內視鏡中心積極規畫中